Butler-Volmer equation:
Exchange current
current-overpotential ($i-\eta$)equation
此处把标准电位$E^{0\prime}$的参考点替换为平衡电位$E_{eq}$,定义过电位Overpotential $\eta = E-E_{eq}$,(1)式可以写成电流与过电位的关系式$\eta-i$
在平衡电位$E_{eq}$,且在平衡状态时,氧化物,还原物各自的本体浓度与表面浓度相等,即与,由方程(1)可得
得到
方程(5)与方程(2)互比得到
变换形式为
把方程(4)带入到(7)中,得:
化简得到
定义过电位表达式为
因此可得:
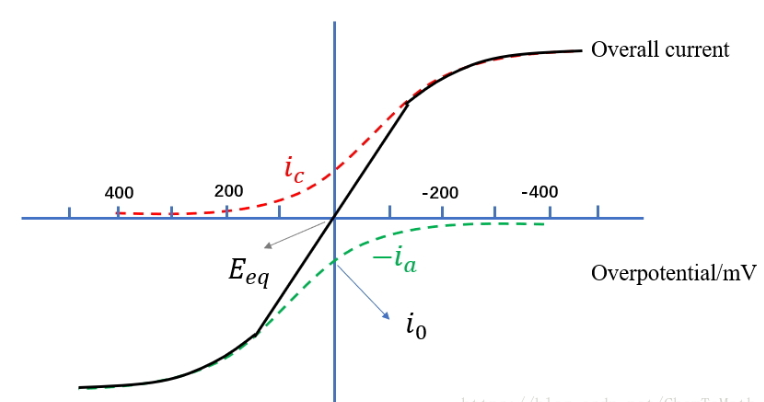
Figure 1. 单步骤单电子氧化还原电对的电流-过电位曲线
从图中可以定性的看出,当过电位越负,总电流几乎和阴极电流$i_c$相近,阳极电流可以忽略;当过电位越正时,总电流几乎和阳极电流$i_a$相近,阴极电流可以忽略。当电位在平衡电位$E_{eq}$附近时,电流变化非常大,这是因为指数项占主导,几乎成指数变化;但是当过电位的绝对值很大的时候,反应速率很大,那么表面的物质浓度就会很小,本体浓度向表面传质速率将会占主导,即使过电位再增加也不能提高电流,因为此时电流(反应速率)已被传质速率控制,所以看到图中的稳定(极限)电流(平线)。
如果不考虑传质的影响。 条件:溶液被充分搅拌,或者电流维持在很小的值,目的是为了让表面浓度surface concentration与本体浓度bulk concentration没有太大差异,保证与的值在0.9-1.1之间, 从(4)可得:
由于不考虑传质的影响,那么交换电流的大小就直接放映了动力学快慢,也就是反应活化能。交换电流越小,活化能越大,越需要大的过电位,才能有电流产生;反之,交换电流越大,活化能越小,则在较小的过电位条件下就可以产生较大的电流。
过电位较小时
当过电位$\eta$绝对值比较小的时,$\dfrac{-\beta F}{RT} \eta$比较小,那么根据$e^x=1+x$ (当$x$足够小时)
过电位较大时,Tafel slope
当过电位很大的时,其中阳极或者阴极电流可以被忽略。比如,当过电位很负时,
则
两边取自然对数,得:
变换得到:
变换为 log
注意,当逆向电流贡献小于1%的时候,Tafel 形式是正确的。
也就是
即在$25 ^oC$时,过电位的绝对值要大于118 mV($\vert \eta \vert >118 mV$)。若果电极动力学很快,而达到极限电流,那么就观察不到Tafel 关系,此时必须要排除传质的影响。当电极动力学很慢的时候,而且需要较大过电位才反应时,此时可以得到较好的Tafel 关系式。因此Tafel 关系式,是不可逆动力学的标志。
Reference
[1] Allen J. Bard, Larry R. Faulkner; Electrochemical methods-Fundamentals and applications.